Peamine erinevus: element on puhas keemiline aine, millel on üks või üks aatomitüüp, mille aatomi number eristub. Kokku on tuvastatud 118 elementi, mis on jagatud metalli, metalloidide ja mittemetallide vahel. Igal elemendil on oma omaduste kogum. Aatomid on põhiosad, millest kõik on valmistatud. Igal aatomil on unikaalne nimi, mass ja suurus. Aatomite erinevaid tüüpe nimetatakse elementideks.

Element on puhas keemiline aine, millel on üks või üks aatomitüüp, mille aatomi number erineb. Aatomarv on tuletatud elemendi tuumas olevate prootonite arvust. Kokku on tuvastatud 118 elementi, mis on jagatud metalli, metalloidide ja mittemetallide vahel. Igal elemendil on oma omaduste kogum. Enamik elemente on saadaval maa peal, mõned neist on kunstlikult välja töötatud tuumareaktsioonide kaudu. Element on juba toorsaim ja seda ei saa enam jaotada. Kõik elemendid on toodud perioodilises tabelis, mis on loetletud aatomi numbriga.
Aatomid on põhiosad, millest kõik on valmistatud. Aatomid on väikesed, vahemikus 0, 1 kuni 0, 5 nanomeetrit laiusega. Nad on nii väikesed, et neid ei saa isegi mikroskoobi kaudu näha. Aatomite tüüpe on palju. Igal aatomil on unikaalne nimi, mass ja suurus. Aatomite erinevaid tüüpe nimetatakse elementideks.
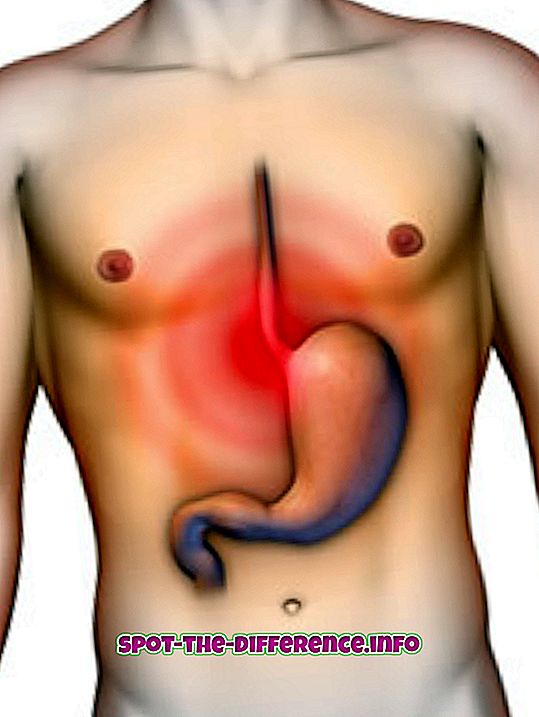
Põhimõtteliselt on aatom üksus, kusjuures elemendid on spetsiifilised ained. Aatom on selle elemendi väikseim võimalik ühik, mis säilitab selle elemendi omadused. Näiteks: raud (Fe) on element. Raua ploki võib jagada raua helvesteks, mida saab seejärel aatomiteks jaotada. Aatomil oleks ikkagi rauda kõik omadused, sealhulgas magnetism.

Aatomites olevate prootonite, neutronite ja elektronide arv määrab selle elemendi. Näiteks: raua aatomil on 26 prootonit, 30 neutronit ja 26 elektroni. Igal raua aatomil on selline konfiguratsioon.
Elemendid on kõikide ainete tüübid. Nad võivad omavahel ühendada molekule. Molekulide valmistamiseks kogunevad erinevate elementide aatomid. See toimub keemilise reaktsiooni kaudu. Näiteks: kaks vesinikuaatomit ja üks hapnikuaatom ühendavad veemolekuli.