Oluline erinevus : Positiivne ioon ja negatiivne ioon on aatomi või molekuli osa. Nende kahe iooni peamine erinevus on ioonide netoelektriline laeng, kusjuures positiivse iooniga on puhas negatiivne laeng ja negatiivne ioon on positiivse positiivse laenguga.
Keemias loetakse aatom ainet kõige väiksemaks osaks. Ja asi on see, mida kogu universum tegi. Niisiis, kõik ained, elavad või elavad organismid koosnevad aatomitest. Aatom koosneb väikesest tuumast, mis koosneb prootonitest, neutronitest ja elektronidest. Aatomis on ainult prootonid ja neutronid, samas kui elektronid pöörlevad ümber tuuma pühendatud ringjoonel.
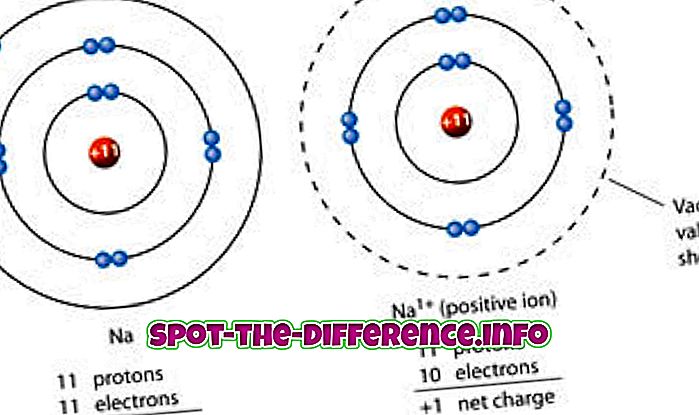
Ionid on defineeritud kui molekul või aatom, kus elektronide koguarv ei ole võrdne prootonite koguarvuga, andes seega aatomile positiivse või negatiivse netomahu. Nüüd, kui ioon on moodustatud elektronide kadumisest, tekib positiivne laeng ja kui see moodustub elektronide võimendusest, siis saadakse osakestele negatiivne laeng. Seda kogu protsessi nimetatakse ionisatsiooniks.
Ioniseerimisel nimetatakse seda positiivse laenguga iooniks "positiivseks iooniks" või "katiooniks". Katioon on ioon, millel on suurem hulk prootoneid kui elektronid. See moodustub siis, kui neutraalne ioon kaotab oma ühe elektroni karmistuskestalt ja tuumades olevate prootonite arv on kõrgem kui väliskestas olevate elektronide arv. Ja vähemate elektronide arvu tõttu saavutab ioon positiivse laengu.

Nii anioone kui ka katioone saab edasi jaotada sõltuvalt mitmekordsetest laengutest. Ja kõiki ülaltoodud tingimusi kasutatakse üksikute maksude puhul. Positiivsed ioonid ja negatiivsed ioonid on diferentseeritud alltoodud tabelis.
Positiivse iooni ja negatiivse iooni võrdlus:
Positiivne ioon | Negatiivne ioon | |
Määratlus | Aatom või molekul, mis on negatiivselt laetud ehk omab rohkem elektronide arvu kui prootonid. | Aatom või molekul, mis on positiivselt laetud, st omab rohkem prootoneid kui elektronid. |
Neto-tasu | See on negatiivne netolaengu ioon. | See on positiivne netolaengu ioon. |
Ioniseerimine | See protsess on looduses eksotermiline. | See protsess on looduses endotermiline. |
Elektrood | Elektrolüüsi ajal tõmbub see anoodi külge. | Elektrolüüsi ajal tõmbub see katoodi külge. |
Moodustas | Nad on moodustatud elektronide meelitamisega. | Nad moodustatakse elektronide kaotamise teel. |
Nimetatud ka | Anion | Katioon |
Elementi tüüp | Mittemetallist | Metal |
Näited | Sulfiid, fluoriid, kloriid, bromiid, jodiid, nitriid ja hüdriid. | Naatrium, raud ja plii. |